第一次从课本上了解到,“成熟的红细胞会失去细胞核和细胞器,在体内主要负责运输氧气”。后来了解到,人体内30万亿个红细胞们可不单纯是个氧气搬运工。由于数量庞大、几乎能够走遍人体内每一个角落,红细胞还担任着“哨兵”重任,及时察觉体内的病原体或损伤,向免疫系统发出警告。最近,又有研究团队发现,红细胞的细胞表面还能黏附DNA分子,从而参与先天免疫!
来自美国宾夕法尼亚大学佩雷尔曼医学院的Nilam S. Mangalmurti及其团队发现,人体内一种富含CpG的DNA分子的出现与炎症发生相关,而红细胞表达的Toll样受体9(TLR9)能够识别并结合这种DNA,进而被巨噬细胞识别并一同清除,缓解炎症引起的组织损伤。
这不仅证明了红细胞是先天免疫中至关重要的一员,更是解释了为什么发生全身炎症后总伴随有贫血。
文章发表在《科学·转化医学》期刊上。
对于CpG DNA,大家可能会不太熟,就是一种富含5'-C-磷酸-G-3'的DNA分子。分子具体长啥样在这儿不重要哈,总之,入侵人体的病原体都会携带这种DNA,而且当体内细胞受损时也会释放CpG DNA。
研究发现,体内游离的CpG DNA水平上升,与恶性肿瘤、自身免疫性疾病、败血病的发生显著相关。
那么,人体内是如何对付这些信号DNA分子呢?
其实在2018年时Mangalmurti的团队就证明,红细胞是清除CpG DNA、减轻肺组织损伤所必需的。他们发现,当人体发生炎症时,红细胞能够通过表达TLR9来识别并结合游离的CpG DNA,进而……,减轻组织损伤。
这组省略号真不是奇点糕偷懒。当时虽然Mangalmurti和他的团队发现红细胞能够捕获CpG DNA,但在这之后呢?粘在红细胞上的CpG DNA又是如何被清除的?这给Mangalmurti的团队留下了深深的疑惑。
2018年时,Mangalmurti和他的团队就有了这一发现
而现在,Mangalmurti和他的团队把这重要的一环补上了!首先他们做了一个小小的补充。
在之前的实验中,他们只在红细胞的胞内检测到TLR9。这次,他们成功在小鼠和人的红细胞表面都检测到了,并且发现在哺乳动物中TLR9的表达很保守,DNA结合结构域在胞外。
确定了红细胞是依靠细胞表面的TLR9与CpG DNA识别并结合的,研究者们开始想:身上多了个附件,会对红细胞的形态有什么影响呢?
他们发现,少量CpG DNA的结合对红细胞来说还是小case,没有什么影响。但当细胞表面结合的CpG DNA多起来后,红细胞还是会不堪重负,细胞骨架蛋白分布出现明显变化,整个细胞变得皱缩,不过还保持着细胞膜完整性。

这是正经的红细胞——结合大量CpG DNA后会发生皱缩
不仅如此,一旦带上这些CpG DNA还会让红细胞丢了性命。在骨髓中产生后,红细胞会在血液循环中持续大约 120 天。在它们的一生中,红细胞多次通过肝脏和脾脏,在那里遇到巨噬细胞,而巨噬细胞通常会将老化和受损的红细胞吞噬掉。
正常的红细胞能在巨噬细胞面前安全通过,是因为细胞表面表达有CD47,这是一种“别吃我”的信号。巨噬细胞一看见红细胞举着CD47,就不再刁难。
可是,结合上CpG DNA的红细胞再遇到巨噬细胞时,一摸兜——我的免死金牌呢!
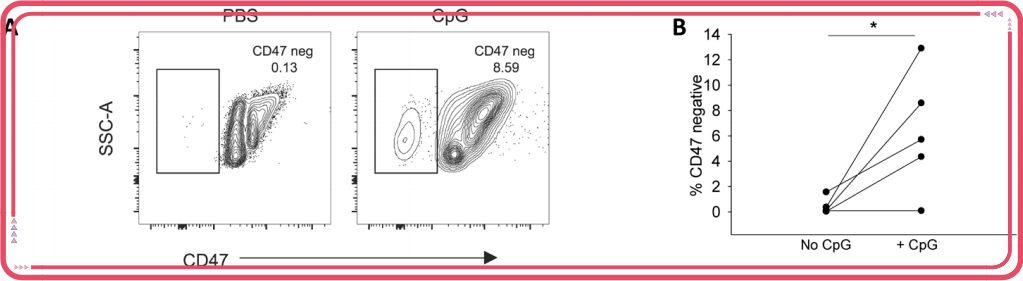
没错。研究者们发现,大量CpG DNA结合在红细胞表面后,会引起红细胞表面的CD47构象发生改变,“别吃我”信号缺失。
用抗体CC2C6来检测CD47的表达情况
巨噬细胞也不客气,既然没有免死金牌,那就——“吸溜~”就这样,当你发生全身炎症时(在此祝愿大家都不会发生),你的红细胞抱着众多CpG DNA分子同归于尽了。
CpG DNA一减少,免疫系统就冷却了;红细胞一少,贫血也就来了。
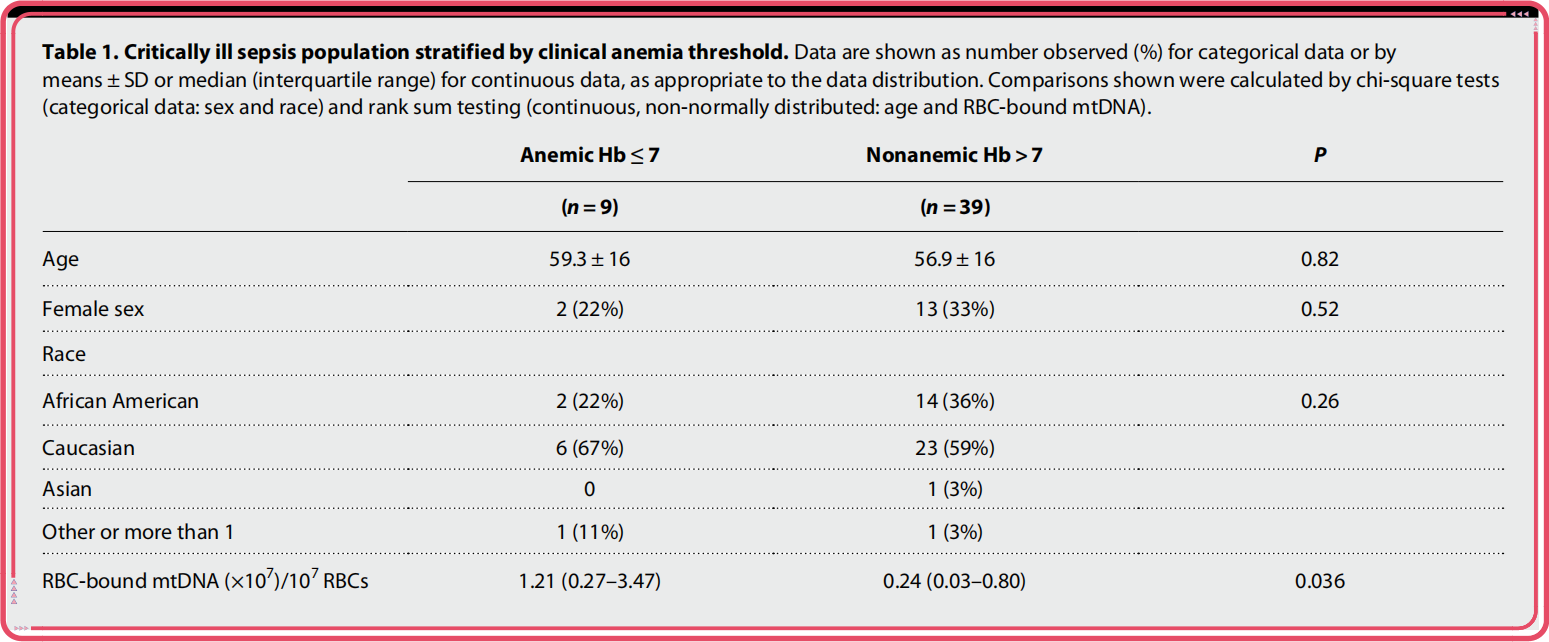
研究者们还从重度败血症患者中,选取出发生贫血(n=9)和没有发生贫血(n=39)的患者进行对比。结果显示,和没贫血的患者相比,发生贫血的败血症患者体内,结合有CpG DNA的红细胞水平确实更高,这也意味着有更多的红细胞带着CpG DNA会一同被清除,导致患者发生贫血。

CpG DNA的结合会加速红细胞被巨噬细胞吞噬,引起贫血
其实,在CpG DNA扫除行动中,红细胞一方面能通过“慷慨赴死”来帮助巨噬细胞清除CpG DNA,避免炎症造成组织损伤;另一方面,还能启动先天免疫反应,告诉免疫系统“危险的病原体来了or机体有损伤了,快给点儿反应!”
研究者们把结合有CpG DNA的红细胞注射到小鼠体内,结果这引起了小鼠的全身炎症。在注射后6小时,小鼠血浆内IFN-γ和IL-6水平显著提高,中性粒细胞浸润明显增加。也就是说,红细胞可以通过结合CpG DNA,向免疫系统发出警告,引发先天免疫反应。
红细胞结合上CpG DNA也会引发炎症,启动先天免疫
在研究的过程中,研究者们也再次确定了红细胞参与清除CpG DNA是依赖于TLR9的。他们发现,在炎症环境下,红细胞表面的TLR9表达量增多。如果TLR9缺失,那红细胞则不会参与CpG DNA的清除,也不会被巨噬细胞大量吞噬。
总的来说,虽然早在鱼类和鸟类中证实红细胞参与机体免疫、抵御病原体等,但在人类和其他哺乳动物中,红细胞的免疫作用还是谜团颇多[2-4]。
此次Mangalmurti的团队就发现,红细胞在人体免疫系统中的地位远超我们的想象!在炎症环境下,红细胞能够通过细胞表面的TLR9识别并结合血液里游离的CpG DNA分子,再由巨噬细胞清除掉结合着大量CpG DNA的红细胞,缓解炎症。而红细胞与CpG DNA的结合,也能引起先天免疫反应。
这项研究算是解释清了一个令人迷惑已久的临床现象。“几乎所有重症监护患者在进入ICU的第三天都发生贫血”,Mangalmurti 说。研究者们还建议,如果能阻止红细胞和血液中游离的CpG DNA结合,或许能解决败血症、新冠患者常出现的贫血问题。
声明:本平台所发布咨询,如非特别注明,均来源于互联网的公开信息,版权归属于著作权人。本平台所发布的咨询均用于免费的交流与学习,非商业用途。我们尊重著作权人的合法权益,如著作权人对本平台发布的内容有异议或涉及权利纠纷,请及时与我们联系,谢谢。