血小板无效输注(platelet transfusion refractoriness, PTR)是指患者在连续2次或多次接受足够剂量的随机供者来源的ABO血型相合的血小板输注后,血小板计数未见有效增加。
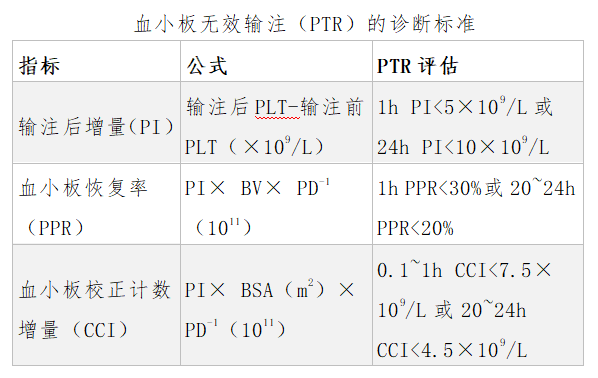
一般情况下输注1个治疗量单采血小板,可以使患者血小板计数升高约为10-20×109/L,血小板输注疗效评价不能以血小板计数升高与否作为判断的唯一指标,要结合患者病情以及输血次数等方面综合考虑。病人在止血过程中也要消耗血小板,如果出血症状有改善,也是表明输血有效,需要我们医务工作者综合考虑判断。目前主要有三个指标来量化评估血小板输注效果,包括输注后增量(PI)、血小板恢复率(PPR)和血小板校正计数增量(CCI)。具体计算公式及诊断标准见表。
血小板无效输注(PTR)的诊断标准
注BV:血容量,可参考Nadler公式计算;BSA:体表面积,参考许文生氏公式计算;PD:输注血小板量,一般每10 U或每治疗量单采血小板的血小板数量≥2.5×1011。
CCI计算公式=(输后血小板计数-输前血小板计数)×体表面积 ÷输入血小板总数(1011),其中体表面积=0.0061×身高(cm)+0.0128×体重(Kg)-0.01529。
PPR计算公式=(输后血小板计数-输前血小板计数)×血容量(L)÷输入血小板总数×2/3。
推荐PTR评估标准为连续两次输注ABO血型相合的新鲜血小板后20~24 h CCI<4.5×109/L和(或)PPR<20%。
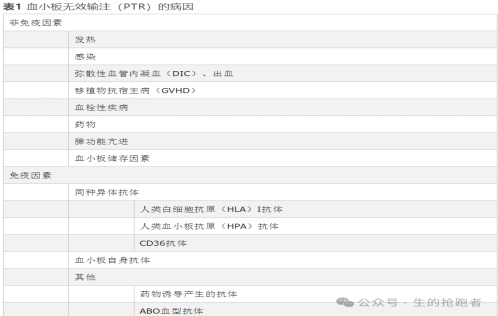
一、免疫因素
免疫因素主要包括:人类白细胞抗原(HLA)抗体、人类血小板抗原(HPA)抗体和CD36抗体所导致的同种异体免疫反应,多发生在有妊娠、器官移植和多次输血等情况的患者,此外,还包括CD47抗体、CD38抗体等。
1.HLA-Ⅰ类抗体:HLA-Ⅰ类抗体是PTR最主要的免疫介导因素,占免疫因素的80%-90%。HLA是人类主要组织相容性复合体(MHC)基因簇的编码产物,分为Ⅰ类和Ⅱ类抗原,血小板表面主要表达Ⅰ类抗原,包括HLA-A、B、C位点抗原,其中PTR发生主要受HLA-A、B位点影响。HLA具有高度免疫原性,当患者初次输注血小板时,机体通过直接和间接两种途径识别异体HLA抗原,激活记忆性T细胞,当机体再次接触该抗原时,致敏T细胞迅速启动免疫应答,激活B细胞,产生抗体,表达相应HLA抗原的血小板则会被清除。
2.HPA抗体:HPA是血小板特有抗原,定位于血小板膜糖蛋白(glycoprotein)复合物上,去白细胞不影响其产生。HPA抗原变异性低于HLA,因此,同种异体免疫的发生率较低,为2%-11%。HPA抗体单独致PTR较少见,常和HLA抗体共同作用。
3.CD36抗体:血小板表面CD36又称GP Ⅳ,能促进血小板聚集和黏附,缺失影响血小板功能。CD36抗原缺失者接受输血、器官移植、妊娠、流产等刺激后机体产生CD36同种抗体,再次输注CD36抗原阳性血小板可导致PTR。
4.血小板自身抗体:可见于自身免疫系统紊乱等导致的疾病,其血小板相关免疫球蛋白非特异地与血小板表面抗原结合,导致血小板易被单核巨噬系统等清除,显著减少输注血小板的存活期。
5.其他:部分药物也可通过诱导产生半抗原介导的抗体、“奎宁型”抗体、药物特异性抗体、纤维蛋白原受体拮抗剂依赖性抗体、非特异性自身抗体和免疫复合物等多种免疫途径介导PTR的发生。此外,血小板表面也表达或从血浆中吸附少量ABO血型抗原,成为发生PTR的潜在原因。
二、非免疫因素
非免疫因素导致PTR主要通过血小板消耗及破坏增加引起血小板减少,主要包括以下因素:
1.发热:发热是PTR的危险因素之一,发热患者体内产生的白细胞介素1(IL-1)、IL-6、肿瘤坏死因子等致热源水平增加,进而激活单核-巨噬细胞系统,导致血小板破坏增加。
2.感染:病原体及其代谢产物免疫刺激作用、内毒素直接损害、网状内皮系统捕获等可导致血小板激活和消耗增加。另外,巨核细胞分化和成熟也会受到影响。
3.血栓:血小板沉积是血栓形成的重要环节,血栓形成过程中血小板聚集、活化和消耗增加,影响血小板输注效果。
4.弥散性血管内凝血(DIC): DIC以凝血因子大量消耗、微血栓形成和出血为主要特征。该过程中血小板激活并消耗,继发出血者,血小板丢失增加,共同导致PTR。
5.出血:大量出血增加血小板消耗,且随后的紧急扩容可引起血液相对稀释,是导致PTR的原因之一。
6.移植物抗宿主病(GVHD):急性和慢性GVHD患者除存在微血管病变外,血循环中血小板相关免疫球蛋白水平也可增加,导致血小板在循环中清除的速度加快。
7.药物:药物相关性血小板减少较为常见(如非甾体类抗炎药和化疗药物)。血液恶性肿瘤患者使用的大部分化疗药物可抑制骨髓,损害巨核细胞,诱导血小板凋亡。
8.脾功能亢进与巨脾:脾脏是血小板的重要破坏场所,脾亢与巨脾导致血小板破坏增加。
9.血小板储存因素:血小板在20-24 ℃持续震荡条件下储存时间不超过5 d,储存时间延长会导致血小板质量下降,影响输注效果。
三、应对策略
(一)处理非免疫因素
非免疫因素是PTR的主要原因,应结合患者的临床表现进行个体化治疗,处理原发病。包括积极抗感染、纠正DIC、减停可疑药物、及时控制移植后GVHD及血栓相关疾病。脾亢或巨脾引起血小板减少患者可考虑脾切除或者增加首次血小板输注量。
(二)选择合适来源的血小板
1.去白细胞和辐照的血小板:有危险因素存在的患者应预防性输注去白和辐照的血小板,以减少同种免疫的发生。白细胞是HLA同种免疫的主要原因,因此在血小板采集或输注前过滤白细胞,能有效减少长期输注血小板患者的HLA同种免疫发生。辐照可通过灭活淋巴细胞减少血小板和白细胞表面的HLA抗原,既可降低血小板抗体的产生,又不影响血小板功能,但对体内已经存在的抗体无作用。
2.交叉匹配的血小板:将患者血清与多个供者来源血小板进行交叉反应,阴性者即为交叉匹配相合血小板,此方法无需进行HLA分型,耗时短、检测便捷,对包括HLA、HPA等所有抗体类型导致的PTR均有效,可广泛开展。但每次输注均需要进行交叉匹配,且异体免疫风险增加,影响HLA匹配血小板的供应。
3.HLA匹配的血小板:对于HLA抗体导致的PTR,建议选择性输注与患者HLA完全匹配或者允许性错配的血小板,HLA匹配程度分可为A、BU、BX、C、D级,具体见表4。其中A和BU级匹配血小板输注效果最好,优于交叉匹配,但需要有大量HLA分型明确的库存血小板。C级、D级匹配度较弱,几乎与随机供者来源血小板输注效果相似,该方法对HPA抗体导致的PTR无效。另外,也可尝试HLA表位匹配的血小板。
表4 HLA匹配度分级
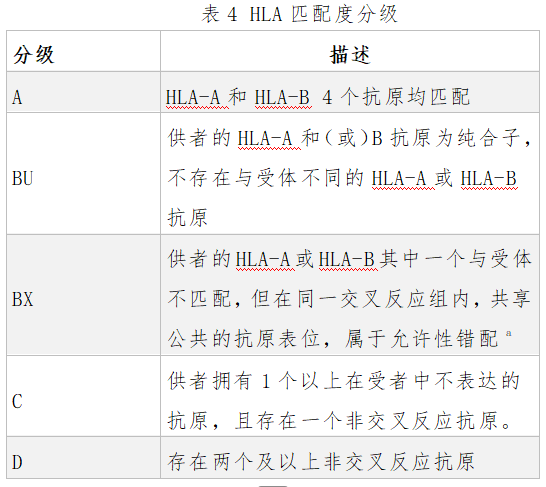
注a其中交叉反应组指因为大多数HLA抗体是针对HLA抗原的公共位点,因此基于交叉反应组的匹配属允许性错配
4.HLA相容血小板:该种方法仅要求根据患者的特异性抗体,选择缺乏相应抗原的供者,只需检测患者HLA抗体,增加了合适供者范围。部分HLA抗体存续时间短暂,需重复检测,以获得合适来源的血小板。
(三)免疫治疗
针对免疫因素导致的无效输注,若无匹配血小板,可选择合适的方法清除体内抗体和(或)抑制抗体产生。
1.静脉输注免疫球蛋白(IVIG):IVIG可通过封闭抗体而减少血小板破坏,对于伴有免疫异常的严重血小板减少患者有一定疗效。推荐剂量为0.4 g·kg-1·d-1,于输注血小板前静脉滴注。
2.利妥昔单抗:利妥昔单抗能特异性地与B细胞表面跨膜抗原CD20结合,介导B细胞溶解的免疫反应,可清除体内B淋巴细胞,减少抗体的产生,可单次或多次使用。排除相关禁忌症情况下,推荐HLA抗体阳性患者单次剂量375 mg/m2。
3.血浆置换:必要时使用新鲜冰冻血浆进行血浆置换。
4.大剂量血小板输注:在无法获得匹配血小板的情况下,若合并严重出血,大剂量随机供者来源血小板输注可吸附血小板抗体,降低血小板输注需求。
(四)其他治疗
严重出血时,如果无法获得HLA匹配的血小板,也可输注随机供者来源血小板。在排除用药禁忌和注意药物相关不良反应的前提下,可根据实际需要,合理使用以下治疗手段:
1.抗纤溶药物:抗纤溶药物通过保护已形成的纤维蛋白凝块不被溶解而发挥止血作用,从而减少血小板输注,可作为PTR的附加治疗。常用氨基己酸和氨甲环酸。
2.重组人凝血因子Ⅶa(rFⅦa):rFⅦa可在血管损伤部位与组织因子结合通过促进凝血酶的生成发挥局部促凝止血作用。推荐剂量60-120 μg/kg,用药间隔6-12 h。rFⅦa可促进凝血酶生成、介导血小板快速活化,在血小板减少时也能发挥止血作用,既往有血栓病史及血栓形成倾向患者应进行凝血相关检查、评估血栓风险。
3.血小板生成素及其受体激动剂:可尝试使用促进巨核细胞分化、成熟及产板的药物,包括重组人血小板生成素、血小板生成素受体激动剂、IL-11等,以治疗血小板减少,促进血小板数量尽快恢复。
4.脾切除术:在其他方法均无效并排除相关禁忌证的前提下,择期行脾切除术可减少血小板在脾脏中的破坏,从而改善PTR。